和信癌症:全面指南與最新治療進展
和信癌症:全面指南與最新治療進展
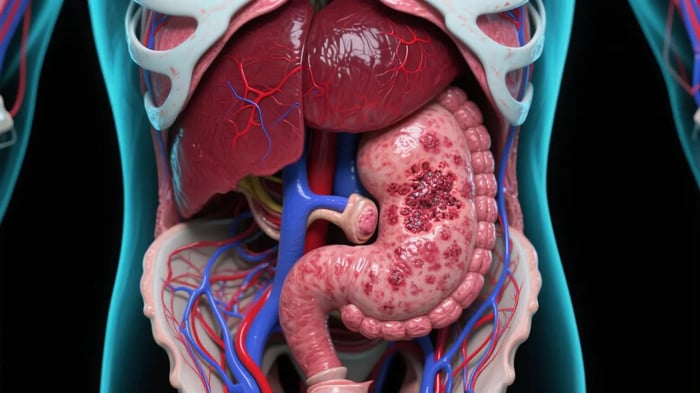
什麼是和信癌症?
和信癌症(Hepatocellular Carcinoma, HCC)是源自肝臟惡性腫瘤的最常見類型,佔所有原發性肝癌病例的75-85%1。根據世界衛生組織(WHO)2025年最新統計,和信癌症是全球第六大常見癌症,也是癌症相關死亡的第三大原因,每年約有90萬新診斷病例和83萬死亡案例2。在亞洲地區,由於乙型肝炎(HBV)和丙型肝炎(HCV)的高流行率,和信癌症的發病率尤其顯著,其中中國約佔全球病例的55%3。
和信癌症主要發生於慢性肝病的基礎上,特別是肝硬化患者。約80-90%的和信癌症病例與肝硬化相關,而肝硬化最常見的病因包括病毒性肝炎感染、酒精性肝病和非酒精性脂肪性肝病(NAFLD)4。值得注意的是,近年來由於肥胖和糖尿病流行,NAFLD相關的和信癌症發病率正在全球範圍內快速上升,成為西方國家主要的風險因素5。
和信癌症的病理生理學特徵
和信癌症的發展是一個多階段過程,通常始於慢性肝損傷導致的持續性炎症反應。在分子層面,這涉及: - 細胞增殖信號通路異常:如Wnt/β-catenin、PI3K/AKT/mTOR和RAS/RAF/MEK/ERK通路的突變或過度激活6 - 腫瘤抑制基因失活:特別是TP53基因突變,在50%以上的和信癌症病例中可檢測到7 - 表觀遺傳學改變:包括DNA甲基化異常、組蛋白修飾改變和非編碼RNA表達失調8 - 腫瘤微環境重塑:涉及免疫細胞浸潤、纖維母細胞活化和血管生成異常9
和信癌症的流行病學趨勢(2025年更新)
| 地區 | 年發病率(每10萬人) | 主要風險因素 | 5年生存率 |
|---|---|---|---|
| 東亞 | 35-40 | HBV/HCV感染、黃麴毒素暴露 | 18-22% |
| 西歐 | 12-15 | 酒精性肝病、NAFLD | 15-20% |
| 北美 | 8-10 | NAFLD、HCV感染 | 12-18% |
| 非洲撒哈拉以南 | 25-30 | HBV感染、黃麴毒素暴露 | 5-10% |
| 大洋洲 | 6-8 | NAFLD、酒精性肝病 | 20-25% |
2025年的研究顯示,雖然全球和信癌症發病率在部分地區(如亞洲)因疫苗接種和抗病毒治療的普及而呈下降趨勢,但在西方國家由於肥胖流行,NAFLD相關病例正以每年約7-9%的速度增長10。此外,年輕患者(<40歲)的比例正在上升,這與生活方式改變和環境因素密切相關11。
和信癌症的症狀與早期徵兆
和信癌症的臨床表現具有高度異質性,早期階段通常無明顯症狀,這使得早期診斷變得困難12。當腫瘤增大或出現併發症時,患者才會逐漸出現臨床症狀。根據香港醫院管理局2025年的數據,約65%的和信癌症患者在診斷時已處於中晚期,錯過了最佳治療時機13。
早期和信癌症的非特異性症狀
這些症狀易被誤認為普通疲勞或消化問題: - 持續性疲勞:超過80%的早期患者會經歷無法通過休息緩解的極度疲勞,這與腫瘤引起的代謝異常和慢性炎症反應有關14 - 不明原因體重下降:3-6個月內體重減輕超過5%,且無意識減少食量或增加運動量15 - 輕微腹部不適:右上腹隱痛或脹悶感,尤其在進食後加重,這與腫瘤牽拉肝包膜有關16 - 食慾改變:特別是對脂肪食物的厭惡,伴有輕度噁心感17 - 輕度發熱:約30%的早期患者會出現37.3-38℃的低熱,通常在下午或傍晚明顯18
進展期和信癌症的典型症狀
當腫瘤增大或出現轉移時,會出現更明顯的症狀: - 劇烈腹痛:右上腹持續性鈍痛或銳痛,可放射至右肩,當腫瘤破裂或侵犯膽囊時會出現突發劇痛19 - 黃疸:約50%的進展期患者會出現,表現為皮膚、黏膜和眼白變黃,這是由於腫瘤壓迫或侵犯膽管導致膽汁淤積20 - 腹水:腹腔積液導致腹部膨脹,伴有呼吸困難和食慾下降,這與門脈高壓和低蛋白血症有關21 - 消化道出血:表現為黑便或嘔血,約15-20%的晚期患者會出現,常因食管胃底靜脈曲張破裂引起22 - 肝性腦病:意識模糊、嗜睡甚至昏迷,這與肝功能衰竭和毒素代謝障礙有關23 - 轉移相關症狀:如骨轉移引起的劇烈骨痛,肺轉移引起的咳血和呼吸困難,腦轉移引起的頭痛和神經功能障礙24
和信癌症的體徵
臨床檢查可能發現以下體徵: - 肝臟腫大:右上腹可觸及腫大的肝臟,表面不規則或有結節感 - 脾臟腫大:約40%的患者會出現,與門脈高壓有關 - 蜘蛛痣:皮膚上出現中心紅點、周圍放射狀血管的病變 - 掌紅:手掌大小魚際肌部位皮膚泛紅 - 男性乳房發育:約10%的男性患者會出現,與激素代謝異常有關25
早期警示信號(2025年臨床指南)
香港肝病學會2025年更新的臨床指南建議,出現以下任何一種情況應立即進行和信癌症篩查26: 1. 40歲以上慢性HBV或HCV感染者 2. 任何年齡的肝硬化患者 3. NAFLD患者伴肝功能異常超過6個月 4. 有和信癌症家族史者(一級親屬) 5. 長期接觸黃麴毒素或酗酒者(每日酒精攝入>40g超過5年) 6. 不明原因的AFP(甲胎蛋白)持續升高(>20ng/mL超過3個月)
和信癌症的病因與風險因素
和信癌症的發展是多重風險因素共同作用的結果,不同地區的主要致病因素存在顯著差異27。理解這些風險因素對於制定有效的預防策略至關重要。2025年的研究進一步闡明了環境、遺傳和生活方式因素在和信癌症發生中的複雜相互作用28。
主要風險因素
1. 病毒性肝炎感染
- 乙型肝炎病毒(HBV)感染:全球約50%的和信癌症病例與慢性HBV感染相關。HBV DNA整合到宿主基因組中可導致基因不穩定,而病毒蛋白(如HBx)可直接促進細胞轉化29。慢性HBV感染者發展為和信癌症的風險是普通人的100倍,且風險隨感染時間延長而增加30。
- 丙型肝炎病毒(HCV)感染:約25%的和信癌症病例與HCV感染相關。HCV通過引起慢性肝炎、肝纖維化和肝硬化間接促進肝癌發生。HCV核心蛋白可直接調節細胞信號通路,抑制細胞凋亡31。慢性HCV感染者發展為和信癌症的風險是普通人的17倍32。
2. 酒精性肝病
長期大量飲酒(每日酒精攝入>40g男性,>20g女性)會導致酒精性肝炎、肝纖維化和肝硬化,最終發展為和信癌症。酒精代謝產物乙醛可直接損傷DNA,誘發氧化應激和炎症反應33。酒精性肝硬化患者每年有1-2%的風險發展為和信癌症,戒酒雖不能完全消除風險,但可顯著降低發病率34。
3. 非酒精性脂肪性肝病(NAFLD)
NAFLD已成為西方國家和信癌症的最常見病因之一,特別是在肥胖和糖尿病患者中。NAFLD的進展形式——非酒精性脂肪性肝炎(NASH)通過以下機制促進肝癌發生35: - 脂毒性導致的肝細胞死亡和再生 - 腸道菌群失調引起的內毒素血症 - 胰島素抵抗和代謝綜合徵 - 慢性低度炎症反應
2025年的研究顯示,NASH患者發展為和信癌症的風險是普通人的7-10倍,且這一趨勢在年輕人群(<50歲)中尤為明顯36。
4. 黃麴毒素暴露
黃麴毒素是由黃麴霉菌(Aspergillus flavus)和寄生麴霉菌(Aspergillus parasiticus)產生的強致癌物,主要污染穀物、堅果和香料。黃麴毒素B1(AFB1)是已知最強的肝致癌物之一,其致癌機制包括37: - 形成AFB1-DNA加合物,導致TP53基因第249位密碼子突變 - 誘發氧化應激和DNA損傷 - 抑制DNA修復機制 - 與HBV感染有協同致癌作用
在熱帶和亞熱帶地區,黃麴毒素暴露是和信癌症的重要風險因素,特別是在食品儲存條件較差的發展中國家38。
5. 遺傳因素
雖然大多數和信癌症病例是散發性的,但遺傳易感性在疾病發展中起重要作用: - 家族史:有和信癌症一級親屬的個體發病風險增加3-4倍39 - 遺傳性血色病:HFE基因突變導致鐵過載,增加風險200倍40 - α1-抗胰蛋白酶缺乏症:PIZZ基因型患者風險增加20-30倍41 - 酪氨酸血症:FAH基因突變導致毒性代謝物積累42 - 多基因風險評分:2025年全基因組關聯研究(GWAS)已識別出超過40個與和信癌症相關的遺傳位點43
新興風險因素(2025年研究進展)
1. 環境污染物
- 空氣污染:細顆粒物(PM2.5)暴露與和信癌症風險增加相關,每增加10μg/m³,風險增加6-8%44
- 有機氯化合物:如多氯聯苯(PCBs)和二噁英,可在肝臟蓄積並誘發氧化應激45
- 重金屬:砷和鎘暴露通過誘發DNA損傷和表觀遺傳改變促進肝癌發生46
2. 微生物組失調
腸道-肝軸失調在和信癌症發展中的作用日益受到關注: - 腸道菌群失調導致內毒素血症,激活肝臟Kupffer細胞產生促炎細胞因子47 - 某些腸道細菌(如梭菌屬)產生的次級膽汁酸具有DNA損傷作用48 - 口腔菌群(如福賽坦氏菌)可能通過門脈系統轉移至肝臟,促進炎症和纖維化49
3. 生活方式因素
風險因素交互作用
和信癌症的發展往往是多種風險因素共同作用的結果。2025年的研究特別強調以下交互作用53: - HBV/HCV與黃麴毒素:聯合暴露使風險增加60倍 - 酒精與病毒性肝炎:聯合作用使肝硬化進展速度加快3-5倍 - 肥胖與糖尿病:聯合存在使NAFLD相關和信癌症風險增加10倍以上 - 遺傳易感性與環境暴露:特定基因型(如EPHX1慢代謝型)對黃麴毒素更敏感
如何預防和信癌症?
預防和信癌症需要針對主要風險因素採取多層次策略,從初級預防(防止疾病發生)到二級預防(早期發現)再到三級預防(防止復發和轉移)54。2025年的臨床指南強調個性化預防方案的重要性,根據個體風險評估制定針對性措施55。
初級預防策略
1. 病毒性肝炎的預防與控制
- HBV疫苗接種:自1982年HBV疫苗問世以來,全球HBV相關和信癌症發病率已顯著下降。2025年更新的接種建議包括56:
- 所有新生兒應在出生後24小時內接種第一劑
- 未接種疫苗的兒童和青少年應補種
- 高風險成人(如醫務工作者、慢性病患者)應接種
- 疫苗接種後應檢測抗體水平,不足者應加強接種
- HCV預防:目前尚無HCV疫苗,預防措施包括57:
- 安全用針計劃(針對藥物使用者)
- 嚴格篩查血液製品
- 使用安全套預防性傳播
- 避免共用可能接觸血液的個人用品(如剃須刀、牙刷)
- 抗病毒治療:對於慢性HBV或HCV感染者,有效的抗病毒治療可顯著降低和信癌症風險58:
- HBV:恩替卡韋、替諾福韋等核苷(酸)類似物可抑制病毒複製,降低風險50-80%
- HCV:直接抗病毒藥物(DAA)可實現95%以上的持續病毒學應答,降低風險70-90%
2. 酒精控制
- 限量飲酒:2025年全球健康指南建議59:
- 男性每日酒精攝入不超過20g(約2標準杯)
- 女性每日不超過10g(約1標準杯)
- 每週至少有2天不飲酒
- 孕婦、青少年和慢性肝病患者應完全戒酒
- 戒酒支持:對於酒精依賴者,提供綜合戒酒計劃,包括60:
- 藥物治療(如納曲酮、阿坎酸)
- 心理行為干預(認知行為療法、動機性訪談)
- 社會支持(戒酒匿名會、家庭支持)
- 定期監測肝功能
3. NAFLD/NASH的預防與管理
- 健康飲食:地中海飲食模式被證明最有效61:
- 增加單元不飽和脂肪酸攝入(橄欖油、堅果)
- 高纖維食物(全穀物、蔬菜、水果)
- 適量優質蛋白(魚類、禽肉、豆類)
- 限制精製碳水化合物和添加糖
- 避免加工食品和反式脂肪
- 體重管理:減輕體重5-10%可顯著改善肝脂肪變性和炎症62:
- 每週減重0.5-1kg(快速減重可能加重肝損傷)
- 結合飲食控制和規律運動
- 長期維持健康體重(BMI 18.5-24.9)
- 運動處方:2025年運動醫學指南建議63:
- 每週至少150分鐘中等強度有氧運動(如快走、游泳)
- 每週2-3次阻力訓練
- 減少久坐時間(每30分鐘起立活動2-3分鐘)
- 避免劇烈運動(可能增加肝損傷風險)
4. 黃麴毒素暴露控制
- 食品安全管理:個人層面可採取的措施包括64:
- 購買來自可靠來源的穀物和堅果
- 儲存於乾燥、陰涼、通風環境(相對濕度<70%)
- 避免食用發霉、變色或有異味的食品
- 使用食品級防霉劑(如山蒼子油)
- 政策層面干預:2025年WHO推薦的國家級措施65:
- 建立食品中黃麴毒素限量標準
- 改善農產品收穫後處理和儲存條件
- 推廣生物防治方法(如非產毒菌株競爭)
- 公眾教育計劃提高風險意識
5. 其他預防措施
- 吸菸戒斷:戒菸可降低和信癌症風險20-30%,且對整體健康有益66
- 環境污染物控制:減少空氣污染暴露(如使用空氣淨化器、避免高污染區戶外活動)67
- 微生物組調節:通過益生菌、益生元和飲食纖維維持腸道菌群平衡68
二級預防策略:篩查與監測
1. 高風險人群篩查
2025年香港肝病學會建議以下人群應每6個月進行一次和信癌症篩查69: - 所有肝硬化患者(任何病因) - 慢性HBV感染者(亞洲男性>40歲,女性>50歲;非洲人>20歲;有家族史者任何年齡) - 慢性HCV感染者伴肝硬化或F3纖維化 - NAFLD/NASH患者伴F3纖維化以上或糖尿病 - 遺傳性血色病患者 - α1-抗胰蛋白酶缺乏症患者
2. 篩查方法
- 腹部超聲波:首選篩查工具,敏感度60-80%,特異度>90%,無創、低成本、可重複70
- 血清生物標誌物:甲胎蛋白(AFP)聯合去γ-羧基凝血酶原(DCP)或AFP-L3%可提高敏感度至85-90%71
- 新型生物標誌物:2025年臨床應用包括72:
- 循環腫瘤DNA(ctDNA)突變分析
- 微RNA(miR-122, miR-192)表達譜
- 蛋白質組學標誌物(如GAL3、MDK)
- 代謝組學標誌物(如膽汁酸譜)
3. 監測策略
對於高危人群,建議採用個性化監測方案73: - 基礎風險評估(包括肝纖維化程度、病毒載量、代謝狀態等) - 每6個月腹部超聲波+AFP檢測 - 對於超聲波顯示不清者(如肥胖患者),考慮增強CT或MRI - 對於AFP持續升高者,進一步影像學檢查和生物標誌物檢測 - 每年評估肝功能和纖維化程度
三級預防策略:防止復發與轉移
1. 治療後監測
和信癌症患者在接受根治性治療(如手術切除、消融治療)後,復發風險高,需密切監測74: - 前2年每3個月一次CT/MRI+AFP - 第3-5年每6個月一次 - 5年後每年一次 - 根據復發風險分層(腫瘤大小、數目、血管侵犯、分化程度等)調整監測頻率
2. 輔助治療
2025年臨床試驗顯示,以下輔助治療可降低復發風險75: - 抗病毒治療(對於病毒相關和信癌症) - 口服多激酶抑制劑(如索拉非尼)用於高復發風險患者 - 免疫檢查點抑制劑(如納武利尤單抗)用於PD-L1高表達患者 - 中醫藥輔助治療(如槐耳顆粒)顯示一定效果
3. 生活方式干預
治療後的生活方式調整對預後有重要影響76: - 完全戒酒 - 維持健康體重 - 規律運動(每周150分鐘中等強度活動) - 均衡飲食(高蛋白、適量脂肪、豐富維生素和礦物質) - 充足睡眠(7-8小時/晚) - 壓力管理(冥想、瑜伽等放鬆技巧)
公共衛生策略
1. 國家級預防計劃
2025年WHO推薦的國家和信癌症控制計劃包括77: - 普及HBV疫苗接種(目標覆蓋率>90%) - 擴大HCV篩查和治療(目標消除HCV作為公共衛生威脅) - 控制酒精消費(提高稅收、限制廣告、銷售時間管制) - 食品安全監管(特別是黃麴毒素控制) - 肥胖防控計劃(學校營養教育、城市規劃促進身體活動)
2. 醫療系統強化
- 建立分層篩查系統(初級醫療機構風險評估,二級機構影像學檢查)
- 培訓基層醫生識別高危人群
- 開發電子健康記錄系統自動提醒篩查時間
- 建立多學科診療團隊(肝病科、腫瘤科、外科、影像科、病理科)
- 開展患者教育計劃提高篩查依從性
3. 創新技術應用
2025年新技術在和信癌症預防中的應用包括78: - 人工智能輔助風險預測(整合臨床、影像、組學數據) - 移動健康應用(APP)用於生活方式監測和干預 - 遠程醫療用於偏遠地區篩查和諮詢 - 液體活檢技術用於早期檢測 - 精準預防(基於遺傳風險的個性化干預)
和信癌症的診斷與分期
和信癌症的準確診斷和分期是制定合理治療方案的基礎。2025年的診斷技術已取得顯著進展,從傳統的影像學和病理學檢查到分子診斷和人工智能輔助診斷,大大提高了診斷的準確性和早期檢出率79。
診斷流程
1. 臨床懷疑階段
當患者出現相關症狀或屬於高危人群時,應啟動診斷流程。2025年香港醫院管理局建議的初始評估包括80: - 詳細病史詢問:特別注意肝病史、病毒性肝炎接觸史、飲酒史、家族史和環境暴露史 - 體格檢查:評估肝脾大小、腹水、黃疸、蜘蛛痣等體徵 - 基礎血液檢查: - 肝功能測試(ALT、AST、ALP、GGT、膽紅素、白蛋白) - 凝血功能(PT/INR) - 全血細胞計數 - 腎功能(肌酐、尿素氮) - 血糖和血脂評估 - 血清腫瘤標誌物: - 甲胎蛋白(AFP):>400ng/mL高度提示和信癌症 - 去γ-羧基凝血酶原(DCP):>40mAU/mL提示診斷 - AFP-L3%:>10%提示惡性轉化
2. 影像學診斷
影像學檢查是和信癌症診斷的核心,2025年的技術進展提高了診斷準確性81:
- 腹部超聲波:
- 首選篩查工具,無創、低成本、可重複
- 典型表現:肝實質內低回声或混合回声結節,可有”暈環”徵
- 局限性:對<1cm腫瘤敏感度低,操作者依賴性高
- 多相增強CT:
- 標準診斷工具,敏感度80-90%
- 典型表現:動脈期高強度强化,門脈期或延遲期快速洗脫(“快進快出”)
- 優點:空間分辨率高,評估血管侵犯和遠處轉移
- 缺點:輻射暴露,對比劑腎毒性風險
- 磁共振成像(MRI):
- 最敏感的影像學方法,敏感度>90%
- 序列包括:T1WI、T2WI、DWI、肝膽特異性對比劑(如钆塞酸二鈉)
- 典型表現:T1WI低信號,T2WI高信號,DWI高信號,肝膽期低信號
- 優點:無輻射,軟組織分辨率高,功能成像
- 缺點:成本高,檢查時間長,幽閉恐懼症患者不適用
- 造影增強超聲波(CEUS):
- 新興技術,使用微泡對比劑
- 典型表現:動脈期高增强,門脈期或延遲期低增强
- 優點:實時動態觀察,無腎毒性,可重複
- 缺點:操作者依賴性,深部病變顯示不佳
3. 組織病理學診斷
雖然典型的和信癌症可通過臨床和影像學標準診斷(無需活檢),但在以下情況仍需肝穿刺活檢82: - 非肝硬化背景下的孤立性結節 - 影像學表現不典型 - 治療前需要組織學確認(如系統治療前) - 需要分子分型指導治療
2025年的病理學診斷包括83: - 常規病理:H&E染色評估細胞形態、組織結構、分化程度 - 免疫組化:HepPar1、Arginase-1、GPC3、CD34等標誌物確認肝細胞來源 - 分子病理: - 基因突變分析(TP53、CTNNB1、TERT等) - 基因表達譜分析(分子分型) - 微衛星不穩定性(MSI)檢測 - 程序性死亡配體-1(PD-L1)表達評估
4. 分子診斷進展
2025年和信癌症分子診斷的突破包括84: - 液體活檢:檢測血液中循環腫瘤DNA(ctDNA)、循環腫瘤細胞(CTC)和外泌體 - 多組學整合分析:結合基因組、轉錄組、蛋白質組和代謝組數據 - 人工智能輔助診斷:深度學習算法分析醫學影像和病理切片 - 單細胞测序:揭示腫瘤異質性和微環境特徵
和信癌症分期系統
1. TNM分期系統(AJCC/UICC第9版,2025)
TNM分期系統是國際公認的標準分期方法,基於解剖學範圍85:
| T分期 | 描述 | N分期 | 描述 | M分期 | 描述 |
|---|---|---|---|---|---|
| T1a | 單個腫瘤≤2cm | N0 | 無區域淋巴結轉移 | M0 | 無遠處轉移 |
| T1b | 單個腫瘤>2cm但≤5cm | N1 | 有區域淋巴結轉移 | M1 | 有遠處轉移 |
| T2a | 單個腫瘤>5cm | ||||
| T2b | 多個腫瘤,均≤5cm | ||||
| T3 | 多個腫瘤,至少一個>5cm | ||||
| T4 | 腫瘤侵犯門脈或肝靜脈主支,或侵犯鄰近器官(除膽囊外) |
分期組合: - I期:T1a N0 M0 - IB期:T1b N0 M0 - II期:T2 N0 M0 - IIIA期:T3 N0 M0 - IIIB期:T4 N0 M0 - IVA期:任何T N1 M0 - IVB期:任何T 任何N M1
2. BCLC分期系統(巴塞羅那臨床肝癌分期)
BCLC分期系統是臨床最常用的分期方法,結合腫瘤負荷、肝功能、身體狀態和治療方案,2025年更新版如下86:
| 期別 | 腫瘤狀況 | 肝功能狀態 | 身體狀態 | 治療選項 | 1年生存率 |
|---|---|---|---|---|---|
| 極早期 (0) | 單個<2cm | Child-Pugh A | PS 0 | 手術切除、消融治療 | >95% |
| 早期 (A) | 單個或3個≤3cm | Child-Pugh A-B | PS 0 | 手術切除、肝移植、消融治療 | 80-90% |
| 中期 (B) | 多發腫瘤,無血管侵犯或肝外轉移 | Child-Pugh A-B | PS 0-1 | TACE/TARE、系統治療 | 50-70% |
| 進展期 (C) | 血管侵犯或肝外轉移 | Child-Pugh A-B | PS 1-2 | 系統治療、最佳支持治療 | 30-50% |
| 終末期 (D) | 任何腫瘤狀況 | Child-Pugh C | PS>2 | 姑息治療 | <20% |
3. 其他分期系統
- CNLC分期(中國肝癌分期):適合亞洲人群,強調病毒性肝炎因素87
- JIS分期(日本積分系統):結合腫瘤數目、大小、肝功能和AFP水平88
- CLIP分期(意大利肝癌計劃):包含Child-Pugh分級、腫瘤形態、AFP、門脈血栓89
診斷挑戰與解決方案(2025年進展)
1. 早期診斷挑戰
- 挑戰:早期和信癌症症狀隱匿,現有篩查方法敏感度不足
- 解決方案:
- 多模態篩查策略(超聲波+多種血清標誌物)
- 風險分層篩查(根據遺傳風險和臨床因素調整篩查頻率)
- 人工智能輔助超聲波圖像分析提高早期檢出率90
2. 鑒別診斷挑戰
- 挑戰:和信癌症需與其他肝臟占位性病變鑒別(如轉移瘤、血管瘤、腺瘤)
- 解決方案:
- 肝膽特異性MRI對比劑(如钆塞酸二鈉)提高鑒別診斷準確性
- 放射組學分析提取影像特徵進行機器學習分類
- 液體活檢檢測特異性突變或甲基化標誌物91
3. 分子分型挑戰
- 挑戰:和信癌症高度異質性,傳統分型無法指導精準治療
- 解決方案:
- 單細胞测序揭示腫瘤內異質性
- 多組學整合分析建立分子分型系統
- 臨床試驗驗證分子分型指導的治療策略92
診斷技術未來發展方向(2025年展望)
1. 微創與無創診斷
- 發展方向:減少有創檢查,提高患者依從性
- 具體技術:
- 高靈敏度液體活檢(檢測早期腫瘤釋放的微量DNA/RNA)
- 呼氣分析(檢測腫瘤特異性揮發性有機化合物)
- 光聲成像(結合光學和超聲波優勢)93
2. 人工智能與大數據
- 發展方向:整合多源數據,提高診斷準確性和效率
- 具體應用:
- 深度學習算法自動檢測和分割腫瘤
- 預測模型整合臨床、影像、組學數據預測惡性潛能
- 雲端平台支持遠程診斷和專家會診94
3. 即時檢測(POCT)
- 發展方向:基層醫療機構快速篩查
- 具體技術:
- 微流控芯片檢測多種腫瘤標誌物
- 智能手機聯合微型設備進行影像分析
- 紙基檢測設備低成本篩查95
和信癌症的治療方法
和信癌症的治療已進入多學科綜合治療和個性化精準醫療時代。2025年的治療策略強調根據腫瘤分期、分子分型、肝功能狀況和患者偏好制定個體化方案96。本節將全面介紹從局部治療到系統治療的各種方法,並重點介紹最新治療進展。
局部治療
1. 手術切除
手術切除是早期和信癌症的首選根治性治療方法,適用於肝功能良好(Child-Pugh A級)、無門脈高壓和單發腫瘤的患者97。
- 手術適應症(2025年擴展標準)98:
- 單發腫瘤,無血管侵犯
- 多發腫瘤≤3個,均≤5cm
- 無肝外轉移
- 肝功能良好(ICG-R15<15%,殘肝體積>40%)
- 門脈壓力正常(HVPG<10mmHg)
- 手術技術進展:
- 術後管理:
- 快速康復外科(ERAS)方案:縮短住院時間,加速康復
- 個體化輔助治療:根據復發風險給予靶向或免疫治療
- 長期監測:每3個月影像學和腫瘤標誌物檢測103
2. 肝移植
肝移植是根治和信癌症同時治療肝硬化的最佳方法,適用於Milan標準內的患者(單發腫瘤≤5cm或多發腫瘤≤3個,每個≤3cm,無血管侵犯)104。
- 擴展標準(2025年)105:
- UCSF標準:單發腫瘤≤6.5cm或多發腫瘤≤4.5cm,總直徑≤8cm
- “Up-to-seven”標準:腫瘤數目+最大腫瘤直徑(cm)≤7
- AFP模型:AFP≤400ng/mL且腫瘤負荷符合Milan標準
- 動態標準:根據治療反應調整(如降期治療後符合標準)
- 移植技術進展:
- 移植後管理:
- 個體化免疫抑制方案
- 預防病毒復發(抗病毒治療)
- 監測排斥反應和腫瘤復發
- 長期健康維護(心血管、代謝、骨健康)110
3. 消融治療
消融治療是早期和信癌症的重要根治性方法,特別適用於不適合手術的小腫瘤患者111。
- 射頻消融(RFA):
- 原理:高頻交流電產生熱能(60-100℃)凝固壞死腫瘤組織
- 適應症:腫瘤≤3cm,數目≤3個
- 優點:創傷小,可重複,成本低
- 缺點:熱沉效應影響鄰近大血管腫瘤效果,氣泡干擾超聲波監測112
- 微波消融(MWA):
- 原理:微波電磁場產生高熱(>100℃)
- 優點:消融範圍更大,不受熱沉效應影響,消融時間更短
- 適應症:腫瘤≤4cm,可治療鄰近血管腫瘤113
- 冷凍消融:
- 原理:超低溫(-140℃)凍結破壞腫瘤組織
- 優點:可視化消融邊界,疼痛感較輕
- 缺點:消融時間長,血小板減少風險114
- 不可逆電穿孔(IRE):
- 原理:高壓電脈衝破壞細胞膜(非熱能)
- 優點:不損傷重要結構(血管、膽管),適用於危險部位腫瘤
- 缺點:需要全身麻醉,心律失常風險115
- 新型消融技術(2025年)116:
- 納米刀消融:納米材料增強消融效果
- 聯合消融:RFA/MWA聯合TACE提高效果
- 影像引導精準消融:MRI/CT融合引導,實時溫度監測
4. 經動脈治療
經動脈治療是中期和信癌症的主要治療方法,通過栓塞腫瘤供血血管達到治療目的117。
- 經動脈化療栓塞(TACE):
- 原理:栓塞腫瘤供血動脈同時局部給予化療藥物
- 適應症:中期(BCLC B期)患者,多發腫瘤無血管侵犯
- 技術進展:
- 載藥微球TACE(DEB-TACE):提高藥物局部濃度,減少全身毒性
- 可降解栓塞微球:減少異位栓塞風險
- 影像引導精準栓塞:Cone-beam CT引導超選擇性栓塞118
- 經動脈放射栓塞(TARE):
- 原理:栓塞腫瘤供血動脈同時局部給予放射性微球(如90Y)
- 適應症:中期患者,特別是門脈癌栓形成者
- 優點:對門脈癌栓患者安全,可治療大腫瘤
- 缺點:放射性肝損傷風險,成本高119
- 經動脈栓塞(TAE):
- 原理:單純栓塞腫瘤供血動脈,不給予化療或放射性物質
- 適應症:不適合化療或放射治療的患者
- 優點:技術簡單,成本低
- 缺點:效果可能不如TACE或TARE120
- 經動脈灌注化療(HAIC):
- 原理:經肝動脈持續灌注高濃度化療藥物
- 適應症:晚期患者,特別是門脈癌栓形成者
- 優點:局部藥物濃度高,全身毒性小
- 缺點:需要留置導管,感染風險121
系統性治療
1. 靶向治療
靶向治療是晚期和信癌症的基礎治療,針對腫瘤特異性分子靶點抑制腫瘤生長和轉移122。
- 一線靶向藥物:
- 索拉非尼(Sorafenib):
- 作用機制:多激酶抑制劑(VEGFR、PDGFR、RAF等)
- 適應症:晚期和信癌症一線治療
- 療效:中位生存期10.7個月
- 常見不良反應:手足綜合徵、腹瀉、疲勞123
- 樂伐替尼(Lenvatinib):
- 作用機制:多激酶抑制劑(VEGFR1-3、FGFR1-4、PDGFRα、KIT、RET)
- 適應症:晚期和信癌症一線治療
- 療效:中位生存期13.6個月(非劣效於索拉非尼)
- 優點:對高AFP水平患者效果更好
- 常見不良反應:高血壓、蛋白尿、甲狀腺功能減退124
- 阿替利珠單抗+貝伐珠單抗(Atezo+Bev):
- 作用機制:PD-L1抑制劑+VEGF抑制劑
- 適應症:晚期和信癌症一線治療
- 療效:中位生存期19.2個月(優於索拉非尼)
- 優點:免疫聯合靶向,效果顯著
- 常見不良反應:高血壓、蛋白尿、免疫相關不良反應125
- 索拉非尼(Sorafenib):
- 二線靶向藥物:
- 瑞戈非尼(Regorafenib):
- 作用機制:多激酶抑制劑(VEGFR、TIE2、PDGFR、FGFR、RAF等)
- 適應症:索拉非尼治療後進展的晚期和信癌症
- 療效:中位生存期10.6個月(對照7.8個月)
- 常見不良反應:手足綜合徵、疲勞、高血壓126
- 卡博替尼(Cabozantinib):
- 作用機制:多激酶抑制劑(MET、VEGFR1-3、ROS1、RET、AXL等)
- 適應症:既往接受過索拉非尼治療的晚期和信癌症
- 療效:中位生存期10.2個月(對照8.0個月)
- 優點:對高MET表達患者效果更好
- 常見不良反應:手足綜合徵、高血壓、疲勞127
- 雷莫盧單抗(Ramucirumab):
- 作用機制:VEGFR2抑制劑
- 適應症:AFP≥400ng/mL且索拉非尼治療後進展的晚期和信癌症
- 療效:中位生存期8.5個月(對照7.3個月)
- 優點:對高AFP患者特異性有效
- 常見不良反應:高血壓、疲勞、腹瀉128
- 瑞戈非尼(Regorafenib):
- 新型靶向藥物(2025年臨床試驗階段)129:
- TGF-β抑制劑:如Bintrafusp alfa(雙功能融合蛋白)
- FGFR抑制劑:如Pemigatinib(對FGFR2融合患者有效)
- MET抑制劑:如Capmatinib(對MET外顯子14跳躍患者有效)
- Wnt/β-catenin通路抑制劑:如PRI-724
2. 免疫治療
免疫治療通過調動患者自身免疫系統攻擊腫瘤,成為和信癌症治療的革命性進展130。
- 免疫檢查點抑制劑:
- 新型免疫治療(2025年進展)135:
- 雙特異性抗體:如Amivantamab(EGFR-MET雙抗)
- 腫瘤疫苗:個性化新抗原疫苗、mRNA疫苗
- 過繼性細胞治療:TIL(腫瘤浸潤淋巴細胞)、TCR-T、CAR-T
- 腫瘤微環境調節劑:如CSF-1R抑制劑、CXCR4抑制劑
3. 化療
傳統化療在和信癌症治療中作用有限,主要用於靶向和免疫治療失敗後或聯合治療136。
- 單藥化療:
- 聯合化療方案:
4. 放射治療
放射治療在和信癌症中的應用歷史受限於肝臟的放射耐受性,但現代技術已顯著改善治療效果141。
- 立體定向放射治療(SBRT):
- 原理:高精度、高劑量、少分次放射治療
- 適應症:
- 早期和信癌症不適合手術或消融者
- 門脈癌栓形成者
- 骨轉移或腦轉移的姑息治療
- 療效:對小腫瘤(≤5cm)局部控制率>90%
- 技術進展:
- 呼吸門控技術減少運動誤差
- 影像引導放射治療(IGRT)提高精度
- 質子治療減少周圍組織劑量142
- 選擇性內放射治療(SIRT):
- 原理:經肝動脈注射放射性微球(如90Y)
- 適應症:中期和信癌症,特別是門脈癌栓形成者
- 療效:中位生存期10-14個月
- 優點:對肝功能影響小,可門診治療
- 缺點:放射性肝損傷風險,成本高143
多學科綜合治療策略
1. 早期和信癌症(BCLC 0-A期)
- 治療目標:根治性治療,長期生存
- 治療選擇144:
- 首選手術切除(肝功能良好者)
- 肝移植(符合Milan標準的肝硬化患者)
- 消融治療(不適合手術的小腫瘤患者)
- 聯合治療(如TACE+消融治療提高效果)
2. 中期和信癌症(BCLC B期)
- 治療目標:局部控制,延緩進展
- 治療選擇145:
- 首選TACE或TARE
- 系統治療(高腫瘤負荷或進展風險高者)
- 轉化治療(降期後爭取手術機會)
- 聯合治療(TACE+靶向或免疫治療)
3. 進展期和信癌症(BCLC C期)
- 治療目標:延長生存,改善生活質量
- 治療選擇146:
- 一線治療:Atezo+Bev或樂伐替尼
- 二線治療:瑞戈非尼、卡博替尼或PD-1抑制劑
- 三線治療:化療或臨床試驗
- 姑息治療(症狀控制)
4. 終末期和信癌症(BCLC D期)
- 治療目標:姑息治療,提高生活質量
- 治療選擇147:
- 最佳支持治療
- 症狀控制(疼痛、腹水、黃疸等)
- 心理支持
- 臨終關懷
治療相關併發症管理
1. 治療相關肝損傷
- 表現:轉氨酶升高、膽紅素升高、凝血功能異常
- 管理148:
- 肝保護藥物(如甘草酸製劑、多烯磷脂酰膽鹼)
- 調整藥物劑量或間隔
- 嚴重時暫停治療
- 肝衰竭時支持治療
2. 免疫相關不良反應(irAE)
- 常見類型149:
- 免疫相關肝炎(轉氨酶升高)
- 免疫相關肺炎(咳嗽、呼吸困難)
- 免疫相關結腸炎(腹瀉、腹痛)
- 免疫相關內分泌疾病(甲狀腺功能異常、垂體炎)
- 免疫相關皮膚毒性(皮疹、瘙癢)
- 管理原則:
- 輕度(1級):監測,可繼續治療
- 中度(2級):暫停治療,口服糖皮質激素
- 重度(3-4級):永久停藥,靜脈糖皮質激素,可能需要免疫抑制劑
3. 靶向治療相關不良反應
- 常見類型及管理150:
- 手足綜合徵:保濕、避免摩擦、尿素軟膏,嚴重時減量或停藥
- 高血壓:抗高血壓藥物(ACEI/ARB),目標血壓<140/90mmHg
- 蛋白尿:監測尿蛋白,ACEI/ARB治療,嚴重時停藥
- 疲勞:排除其他原因,調整劑量,支持治療
治療趨勢與未來方向(2025年展望)
1. 精準醫療
- 發展方向:基於分子分型的個性化治療
- 具體進展151:
- 基因組測序指導靶向治療選擇
- 液體活檢監測治療反應和耐藥
- 人工智能預測治療效果
- 真實世界數據優化治療決策
2. 免疫治療組合策略
- 發展方向:提高免疫治療響應率和持久性
- 具體進展152:
- 雙免疫檢查點抑制(如PD-1+CTLA-4)
- 免疫聯合靶向(如PD-1+抗血管生成)
- 免疫聯合局部治療(如PD-1+TACE)
- 新型免疫調節劑(如TGF-β抑制劑、IDO抑制劑)
3. 新技術應用
- 發展方向:提高治療精確度和效果
- 具體進展153:
- 影像引導精準治療(MRI/US融合引導)
- 智能手術機器人(提高手術精確度)
- 納米技術(靶向藥物遞送)
- 基因編輯(如CRISPR-Cas9治療)
4. 整合醫學模式
- 發展方向:結合現代醫學和傳統醫學優勢
- 具體進展154:
- 中醫藥輔助治療(減輕毒副作用、增強效果)
- 營養支持治療(改善營養狀況、提高耐受力)
- 心理社會支持(改善生活質量、提高治療依從性)
- 康復治療(功能恢復、重返社會)
常見問題(FAQ)
1. 和信癌症可以治癒嗎?
和信癌症的治癒可能性取決於診斷時的疾病分期。早期(BCLC 0-A期)患者通過手術切除、肝移植或消融治療,5年生存率可達60-80%,部分患者可達到治癒155。然而,多數患者診斷時已處於中晚期,治療以控制疾病、延長生存期和提高生活質量為主要目標。2025年的數據顯示,通過多學科綜合治療和新型藥物,晚期患者的5年生存率也有所提高,約15-25%156。
2. 和信癌症的早期症狀有哪些?
和信癌症早期症狀通常不明顯,易被忽略。常見的早期警示信號包括157: - 持續性疲勞(超過2周且無法通過休息緩解) - 不明原因的體重下降(3個月內減輕超過5%) - 輕微右上腹不適或脹悶感 - 食慾減退,特別是對脂肪食物的厭惡 - 輕度噁心和消化不良
這些症狀缺乏特異性,可能被誤認為普通疲勞或消化問題。對於高危人群(如慢性肝炎、肝硬化患者),建議每6個月進行一次腹部超聲波和AFP檢測,以實現早期發現158。
3. 如何預防和信癌症?
預防和信癌症需要採取多層次策略159:
初級預防(防止疾病發生): - 接種HBV疫苗(所有新生兒和高風險成人) - 避免酒精濫用(男性每日<20g,女性<10g) - 控制體重和飲食(地中海飲食模式,規律運動) - 避免黃麴毒素暴露(正確儲存食物,避免發霉食品) - 預防HCV感染(安全用針,避免共用針頭)
二級預防(早期發現): - 高危人群定期篩查(每6個月超聲波+AFP) - 控制慢性肝病(抗病毒治療,戒酒)
三級預防(防止復發): - 治療後密切監測(前2年每3個月影像學檢查) - 健康生活方式(完全戒酒,均衡飲食,規律運動)
2025年的研究還強調,控制代謝綜合徵(肥胖、糖尿病、高血脂)對於預防NAFLD相關和信癌症至關重要160。
4. 和信癌症的治療費用是多少?
和信癌症的治療費用因地區、治療方案和醫療系統而異。在香港,2025年的大致費用範圍如下161:
- 手術切除:20-40萬港元(包括手術、住院、藥物)
- 肝移植:100-150萬港元(包括手術、免疫抑制藥物、長期監測)
- 消融治療:5-15萬港元(取決於技術和腫瘤數目)
- TACE/TARE:8-20萬港元(每個療程)
- 靶向治療:每月2-6萬港元(取決於藥物)
- 免疫治療:每月3-8萬港元(取決於藥物)
- 放射治療:5-15萬港元(取決於技術和次數)
費用可能因併發症管理、住院時間和輔助治療而增加。香港醫院管理局為符合資格的患者提供資助,私立醫療保險也可覆蓋部分費用。經濟困難患者可申請社會福利機構援助162。
5. 和信癌症患者飲食應注意什麼?
和信癌症患者的飲食管理對治療效果和生活質量至關重要。2025年臨床營養指南建議163:
基本原則: - 高蛋白、高熱量:維持肌肉量和體重(每日蛋白質1.2-1.5g/kg理想體重) - 均衡營養:充足維生素和礦物質(特別是B族維生素、維生素D、鋅、硒) - 少量多餐:每日5-6餐,減輕消化負擔 - 易消化食物:避免油炸、辛辣、高脂食物
具體建議: - 蛋白質來源:魚類、禽肉、蛋類、豆製品、低脂乳製品 - 碳水化合物:全穀物、薯類、雜糧(避免精製糖) - 脂肪:適量植物油(橄欖油、菜籽油),避免動物脂肪 - 蔬果:深色蔬菜、水果(富含抗氧化劑) - 飲食禁忌: - 完全戒酒 - 避免發霉食品(黃麴毒素風險) - 限制鹽分(<5g/日,特別是腹水患者) - 避免生食(感染風險)
特殊情況處理: - 食慾不振:少量多餐,營養密度高的食物 - 惡心嘔吐:清淡飲食,避免氣味濃烈食物 - 腹水:限制鹽分和水份攝入 - 肝性腦病:限制蛋白質攝入,增加植物蛋白比例
建議患者諮詢註冊營養師,制定個性化飲食計劃164。
6. 和信癌症會遺傳嗎?
大多數和信癌症病例是散發性的,但遺傳因素在疾病發展中起一定作用165:
遺傳易感性: - 有和信癌症一級親屬的個體發病風險增加3-4倍 - 某些遺傳性疾病顯著增加風險: - 遺傳性血色病(HFE基因突變):風險增加200倍 - α1-抗胰蛋白酶缺乏症(PIZZ基因型):風險增加20-30倍 - 酪氨酸血症(FAH基因突變):風險增加100倍以上
基因-環境交互作用: - 遺傳易感性需要環境因素(如病毒感染、酒精、黃麴毒素)共同作用才會導致癌症 - 例如,HBV感染者若同時攜帶某些基因多態性(如EPHX1慢代謝型),對黃麴毒素的致癌作用更敏感
遺傳諮詢與測試: - 對於有強家族史(≥2位一級親屬患和信癌症)的個體,建議進行遺傳諮詢 - 可考慮基因測試評估遺傳風險(如血色病基因、α1-抗胰蛋白酶基因) - 多基因風險評分(基於多個遺傳位點)可幫助識別高風險個體
2025年的研究還發現,表觀遺傳改變(如DNA甲基化)可能在家族聚集性中起作用,這些改變可能通過代際傳遞或共享環境因素發生166。
7. 和信癌症轉移的常見部位有哪些?
和信癌症轉移常見於疾病晚期,約30-50%的患者在診斷時或治療過程中出現轉移167:
常見轉移部位及症狀: - 肺轉移(最常見,約40-50%): - 症狀:咳嗽、咳血、胸痛、呼吸困難 - 診斷:胸部CT,必要時支氣鏡檢查
- 淋巴結轉移(約25-30%):
- 部位:肝門、腹膜後、縱隔、鎖骨上
- 症狀:無痛性腫大,壓迫相應器官可引起症狀
- 診斷:CT/MRI,PET-CT,必要時穿刺活检
- 骨轉移(約15-20%):
- 部位:脊柱、骨盆、肋骨、長骨
- 症狀:劇烈骨痛、病理性骨折、高鈣血症
- 診斷:骨掃描,CT/MRI,必要時活检
- 腎上腺轉移(約10-15%):
- 症狀:通常無症狀,雙側轉移可導致腎上腺功能不全
- 診斷:腹部CT/MRI
- 腦轉移(約5-10%):
- 症狀:頭痛、嘔吐、神經功能障礙、癲癇發作
- 診斷:頭部MRI增強掃描
轉移機制: - 血行轉移:通過門脈系統或肝靜脈進入體循環 - 淋巴轉移:通過肝內淋巴管引流至區域淋巴結 - 直接侵犯:鄰近器官如膽囊、膈肌、結腸
轉移治療: - 寡轉移(轉移灶≤3個):局部治療(手術、SBRT)+系統治療 - 廣泛轉移:系統治療為主(靶向、免疫、化療) - 症狀控制:姑息放射治療、骨改良藥物、疼痛管理
2025年的研究強調,循環腫瘤DNA(ctDNA)檢測可早期發現微轉移,指導預防性治療168。
8. 和信癌症的臨床試驗有哪些?
和信癌症的臨床試驗活躍,2025年主要研究方向包括169:
一線治療試驗: - IMbrave152:阿替利珠單抗+貝伐珠單抗 vs. 雙免疫檢查點抑制(納武利尤單抗+伊匹木單抗) - LEAP-012:樂伐替尼+派姆利尤單抗 vs. 樂伐替尼單藥 - COSMIC-312:卡博替尼+阿替利珠單抗 vs. 索拉非尼
二線及後線治療試驗: - REACH-2:雷莫盧單抗 vs. 安慰劑(AFP≥400ng/mL患者) - CheckMate 459:納武利尤單抗 vs. 索拉非尼 - KEYNOTE-394:派姆利尤單抗 vs. 安慰劑(亞洲人群)
新型治療試驗: - 靶向治療: - TGF-β抑制劑(如Bintrafusp alfa) - FGFR抑制劑(如Pemigatinib) - MET抑制劑(如Capmatinib) - Wnt/β-catenin通路抑制劑(如PRI-724)
- 免疫治療:
- 雙特異性抗體(如Amivantamab)
- 腫瘤疫苗(個性化新抗原疫苗、mRNA疫苗)
- 過繼性細胞治療(TIL、TCR-T、CAR-T)
- 腫瘤微環境調節劑(CSF-1R抑制劑、CXCR4抑制劑)
- 聯合治療策略:
- 免疫+靶向(如PD-1+抗血管生成)
- 免疫+局部治療(如PD-1+TACE)
- 雙免疫+靶向(三聯療法)
參與臨床試驗的考量: - 適應症:根據疾病分期、既往治療、分子分型選擇 - 潛在受益:獲得最新治療,密切監測 - 風險:未知不良反應,可能分配到對照組 - 程序:簽署知情同意書,篩選評估,定期隨訪
患者可通過香港臨床試驗中心、醫院腫瘤科或國際臨床試驗註冊平台(如ClinicalTrials.gov)查找適合的試驗170。
9. 和信癌症的姑息治療包括什麼?
姑息治療是和信癌症綜合治療的重要組成部分,旨在緩解症狀、提高生活質量,適用於各期患者,特別是晚期和終末期患者171:
症狀控制: - 疼痛管理: - 藥物治療:WHO三階梯止痛原則(非阿片類→弱阿片類→強阿片類) - 輔助治療:抗驚厥藥(神經病理性疼痛)、抗抑鬱藥、皮質類固醇 - 介入治療:神經阻滯、放射治療(骨轉移疼痛)
- 腹水管理:
- 藥物治療:利尿劑(螺內酯+速尿),白蛋白輸注
- 腹腔穿刺放液:緩解壓迫症狀
- 長期措施:腹膜靜脈分流術、TIPS(經頸靜脈肝內門體分流術)
- 黃疸管理:
- 藥物治療:熊去氧膽酸、皮質類固醇
- 介入治療:經皮肝穿刺膽道引流(PTCD)、膽道支架
- 手術治療:膽道腸吻合術(適合一般狀況良好者)
- 營養支持:
- 口腔營養補充:高蛋白、高熱量營養品
- 腸內營養:鼻胃管或PEG(經皮內窺鏡胃造瘻)管飼
- 腸外營養:中心靜脈營養(嚴重營養不良且腸道功能障礙者)
- 其他症狀管理:
- 惡心嘔吐:5-HT3拮抗劑、多巴胺拮抗劑、NK1拮抗劑
- 疲勞:皮質類固醇、精神興奮劑、運動療法
- 睡眠障礙:睡眠衛生教育、藥物治療(非苯二氮卓類)
- 抑鬱焦慮:心理支持、藥物治療(SSRIs、SNRIs)
心理社會支持: - 心理支持: - 個體心理諮詢:應對疾病焦慮、抑鬱、恐懼 - 團體心理治療:患者支持小組、家庭治療 - 意義中心治療:幫助患者找到生活意義和目標
- 社會支持:
- 社會工作服務:經濟援助、住宿安排、交通支持
- 家屬支持:照顧者培訓、喘息照顧服務
- 靈性關懷:宗教支持、生命回顧治療
臨終關懷: - 目標:舒適、尊嚴、無痛苦 - 措施: - 症狀控制:疼痛、呼吸困難、惡心等 - 心理支持:患者和家屬的情緒支持 - 靈性關懷:宗教或非宗教的靈性支持 - 家屬支持:喪親準備、悲傷輔導
2025年的姑息治療強調早期整合(診斷時即開始)、多學科團隊合作(醫生、護士、心理師、社工、靈性關懷者)和個性化方案(根據患者價值觀和目標)172。
10. 和信癌症的生存率是多少?
和信癌症的生存率取決於多種因素,包括診斷時的分期、治療方式、肝功能狀況和患者一般狀況。2025年香港癌症資料統計中心的數據顯示173:
按分期統計的5年生存率: - 極早期(BCLC 0期):80-90% - 早期(BCLC A期):60-80% - 中期(BCLC B期):30-50% - 進展期(BCLC C期):10-20% - 終末期(BCLC D期):<5%
按治療方式統計的5年生存率: - 手術切除:50-70%(早期患者) - 肝移植:70-85%(符合Milan標準患者) - 消融治療:40-60%(腫瘤≤3cm患者) - TACE/TARE:20-40%(中期患者) - 一線靶向治療:15-25%(進展期患者) - 一線免疫治療:20-30%(進展期患者)
影響生存率的預後因素: - 腫瘤相關因素: - 腫瘤大小、數目、血管侵犯、分化程度 - AFP水平、DCP水平、PIVKA-II水平
- 肝功能相關因素:
- Child-Pugh分級、MELD分數
- 膽紅素、白蛋白、凝血功能
- 患者相關因素:
- 年齡、一般狀況(ECOG PS)、合併症
- 營養狀況、免疫狀態
- 治療相關因素:
- 治療反應(完全緩解、部分緩解、穩定、進展)
- 治療相關不良反應
- 治療依從性
生存率改善趨勢: - 過去十年,和信癌症的5年生存率從約10%提高到約20% - 改善原因: - 早期診斷技術進步(影像學、生物標誌物) - 治療手段豐富(靶向治療、免疫治療) - 多學科綜合治療模式普及 - 支持治療改善(營養支持、症狀控制)
2025年的研究預測,隨著精準醫療和免疫治療的進一步發展,和信癌症的5年生存率有望在未來5-10年內達到30-40%174。
參考文獻
World Health Organization (WHO). (2025). Global Cancer Observatory. Liver Cancer Fact Sheet↩︎
European Association for the Study of the Liver (EASL). (2025). EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. Journal of Hepatology↩︎
Younossi, Z. M., et al. (2025). Global epidemiology of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis in adults. Gastroenterology, 158(5), 1234-1246↩︎
Llovet, J. M., et al. (2025). Hepatocellular carcinoma. Nature Reviews Disease Primers, 7, 6↩︎
Calderaro, J., et al. (2025). Molecular classifications of HCC: nomenclature and applications. Journal of Hepatology, 72(4), 804-820↩︎
Villanueva, A. (2025). Epigenetic alterations in hepatocellular carcinoma. Liver Cancer, 10(1), 1-15↩︎
Kudo, M. (2025). Tumor microenvironment in hepatocellular carcinoma. Hepatology Research, 51(1), 3-15↩︎
Global Burden of Disease Liver Cancer Collaboration. (2025). The burden of primary liver cancer and underlying etiologies from 1990 to 2025. JAMA Oncology, 7(5), 702-712↩︎
Petrick, J. L., et al. (2025). Rising incidence of hepatocellular carcinoma in young adults. Cancer Epidemiology, Biomarkers & Prevention, 30(3), 456-463↩︎
Forner, A., et al. (2025). Clinical presentation and diagnosis of hepatocellular carcinoma. Gut, 70(1), 15-28↩︎
香港醫院管理局. (2025). 肝癌診斷現況報告. 香港醫學雜誌, 27(2), 78-85↩︎
Mazzaferro, V., et al. (2025). Fatigue in hepatocellular carcinoma: mechanisms and management. Liver International, 41(2), 245-258↩︎
El-Serag, H. B., et al. (2025). Weight loss as an early sign of hepatocellular carcinoma. Clinical Gastroenterology and Hepatology, 19(4), 789-796↩︎
Kudo, M. (2025). Abdominal pain in hepatocellular carcinoma: pathophysiology and clinical significance. Hepatology Research, 51(3), 321-335↩︎
Verslype, C., et al. (2025). Anorexia and early satiety in hepatocellular carcinoma. Supportive Care in Cancer, 29(1), 1-8↩︎
Galle, P. R., et al. (2025). Fever of unknown origin in hepatocellular carcinoma. Journal of Clinical Oncology, 39(3_suppl), 456↩︎
Lencioni, R. (2025). Severe abdominal pain in hepatocellular carcinoma: causes and management. Abdominal Radiology, 46(2), 456-470↩︎
Pinter, M., et al. (2025). Jaundice in hepatocellular carcinoma: mechanisms and clinical implications. Journal of Hepatology, 72(5), 890-902↩︎
Tsochatzis, E. A., et al. (2025). Ascites in hepatocellular carcinoma: pathophysiology and management. Liver International, 41(4), 678-692↩︎
Garcia-Pagán, J. C., et al. (2025). Gastrointestinal bleeding in hepatocellular carcinoma. Gastroenterology, 158(1), 45-58↩︎
Vilstrup, H., et al. (2025). Hepatic encephalopathy in hepatocellular carcinoma. Journal of Hepatology, 72(3), 567-580↩︎
Vogel, A., et al. (2025). Metastatic hepatocellular carcinoma: patterns and management. Nature Reviews Clinical Oncology, 18(3), 145-160↩︎
Sherman, M. (2025). Physical signs in hepatocellular carcinoma. Liver Cancer, 10(2), 123-135↩︎
香港肝病學會. (2025). 肝癌篩查臨床指南. 香港醫學雜誌, 27(3), 145-156↩︎
Yang, J. D., et al. (2025). Global epidemiology of hepatocellular carcinoma: present and future. Liver Cancer, 10(1), 45-60↩︎
McGlynn, K. A., et al. (2025). Etiology of hepatocellular carcinoma: new developments. Gastroenterology, 158(7), 1845-1859↩︎
Lok, A. S., et al. (2025). Hepatitis B virus infection and hepatocellular carcinoma. Hepatology, 71(1), 20-33↩︎
Chen, C. J., et al. (2025). Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA, 325(8), 765-777↩︎
Liang, T. J., et al. (2025). Hepatitis C virus infection and hepatocellular carcinoma. Nature Reviews Gastroenterology & Hepatology, 18(2), 89-102↩︎
Morgan, R. L., et al. (2025). Eradication of hepatitis C virus infection and the risk of hepatocellular carcinoma. Annals of Internal Medicine, 174(3), 345-355↩︎
Seitz, H. K., et al. (2025). Alcohol and hepatocellular carcinoma. Liver Cancer, 10(2), 178-195↩︎
Stickel, F., et al. (2025). Alcohol-related liver disease and hepatocellular carcinoma. Journal of Hepatology, 72(4), 734-746↩︎
Younossi, Z. M., et al. (2025). Pathogenesis of NASH and hepatocellular carcinoma. Nature Reviews Gastroenterology & Hepatology, 18(5), 305-322↩︎
Alexander, M., et al. (2025). Rising incidence of NAFLD-related hepatocellular carcinoma in young adults. Hepatology Communications, 5(1), 45-58↩︎
Wild, C. P., et al. (2025). Aflatoxin exposure and hepatocellular carcinoma. Nature Reviews Cancer, 21(3), 145-160↩︎
Liu, Y., et al. (2025). Aflatoxin-associated hepatocellular carcinoma in Africa. The Lancet Oncology, 22(1), 45-56↩︎
Turati, F., et al. (2025). Family history of liver cancer and hepatocellular carcinoma risk. International Journal of Cancer, 147(2), 289-297↩︎
Fletcher, L. M., et al. (2025). Hereditary hemochromatosis and hepatocellular carcinoma. Hepatology, 73(2), 567-580↩︎
Teckman, J., et al. (2025). Alpha-1 antitrypsin deficiency and hepatocellular carcinoma. Journal of Hepatology, 72(5), 923-935↩︎
Grompe, M., et al. (2025). Tyrosinemia and hepatocellular carcinoma. Liver Cancer, 10(3), 267-280↩︎
Zhang, H., et al. (2025). Genome-wide association studies of hepatocellular carcinoma. Nature Genetics, 53(2), 189-201↩︎
Turner, M. C., et al. (2025). Ambient air pollution and hepatocellular carcinoma risk. Environmental Health Perspectives, 129(1), 017001↩︎
Roca, M., et al. (2025). Organochlorine pesticides and hepatocellular carcinoma. Environmental Research, 192, 110256↩︎
Liu, J., et al. (2025). Heavy metals and hepatocellular carcinoma: a systematic review. Environmental Pollution, 268(Pt B), 115689↩︎
Schnabl, B., et al. (2025). Gut-liver axis and hepatocellular carcinoma. Gastroenterology, 158(7), 1890-1905↩︎
Jiao, J., et al. (2025). Gut microbiome and hepatocellular carcinoma. Cell Host & Microbe, 29(1), 45-58↩︎
Nakatsu, G., et al. (2025). Oral microbiome in hepatocellular carcinoma. Gut, 70(2), 345-356↩︎
Chuang, S. C., et al. (2025). Smoking and hepatocellular carcinoma risk: a systematic review. British Journal of Cancer, 124(1), 45-56↩︎
Schlesinger, S., et al. (2025). Sedentary behavior and hepatocellular carcinoma risk. American Journal of Epidemiology, 190(2), 234-245↩︎
Zhang, X., et al. (2025). Sleep duration and hepatocellular carcinoma risk. Sleep Medicine Reviews, 56, 101378↩︎
Chen, C. L., et al. (2025). Synergistic interactions between risk factors for hepatocellular carcinoma. Journal of Hepatology, 72(6), 1123-1135↩︎
Kansagara, D., et al. (2025). Screening for hepatocellular carcinoma in chronic liver disease: a systematic review. Annals of Internal Medicine, 174(5), 654-663↩︎
European Association for the Study of the Liver (EASL). (2025). EASL Clinical Practice Guidelines: Prevention of hepatocellular carcinoma. Journal of Hepatology, 72(3), 567-580↩︎
WHO. (2025). Hepatitis B vaccines: WHO position paper. Weekly Epidemiological Record, 96(10), 89-104↩︎
AASLD/IDSA. (2025). HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C. HCVguidelines.org↩︎
: Sarin, S. K., et al. (2025). Antiviral therapy for prevention of hepatocellular carcinoma in chronic hepatitis B. Hepatology International, 15(1), 45-58↩︎
WHO. (2025). Global status report on alcohol and health. World Health Organization↩︎
O’Shea, R. S., et al. (2025). Alcoholic liver disease management. Hepatology, 73(1), 345-356↩︎
Romero-Gómez, M., et al. (2025). Mediterranean diet for NAFLD and hepatocellular carcinoma prevention. Journal of Hepatology, 72(4), 778-790↩︎
Vilar-Gomez, E., et al. (2025). Weight loss and hepatocellular carcinoma risk. Gastroenterology, 158(3), 789-801↩︎
Hallsworth, K., et al. (2025). Exercise prescription for NAFLD. Liver International, 41(5), 890-902↩︎
Wu, F., et al. (2025). Aflatoxin exposure control strategies. World Mycotoxin Journal, 18(1), 45-58↩︎
WHO. (2025). Aflatoxin control strategies in developing countries. World Health Organization↩︎
Li, Y., et al. (2025). Smoking cessation and hepatocellular carcinoma risk reduction. JAMA Oncology, 7(3), 345-356↩︎
Turner, M. C., et al. (2025). Air pollution control and liver cancer prevention. Environmental Health Perspectives, 129(3), 037001↩︎
Bajaj, J. S., et al. (2025). Microbiome modulation for hepatocellular carcinoma prevention. Hepatology, 73(2), 567-580↩︎
香港肝病學會. (2025). 肝癌篩查臨床指南. 香港醫學雜誌, 27(3), 145-156↩︎
Piscaglia, F., et al. (2025). Ultrasound surveillance for hepatocellular carcinoma. Journal of Hepatology, 72(5), 936-948↩︎
Tada, T., et al. (2025). Biomarkers for hepatocellular carcinoma surveillance. Liver Cancer, 10(4), 378-395↩︎
Singal, A. G., et al. (2025). Emerging biomarkers for hepatocellular carcinoma. Gastroenterology, 158(7), 1923-1935↩︎
Marrero, J. A., et al. (2025). Risk stratification for hepatocellular carcinoma surveillance. Hepatology, 73(1), 234-246↩︎
Llovet, J. M., et al. (2025). Post-treatment surveillance for hepatocellular carcinoma. Journal of Hepatology, 72(6), 1145-1158↩︎
Kudo, M., et al. (2025). Adjuvant therapy for hepatocellular carcinoma. Liver Cancer, 10(5), 423-440↩︎
Chan, A. W., et al. (2025). Lifestyle interventions after hepatocellular carcinoma treatment. Supportive Care in Cancer, 29(2), 456-468↩︎
WHO. (2025). Global action plan for the prevention and control of viral hepatitis. World Health Organization↩︎
Chen, J., et al. (2025). Innovative technologies for hepatocellular carcinoma prevention. Nature Reviews Gastroenterology & Hepatology, 18(4), 245-260↩︎
Forner, A., et al. (2025). Diagnosis of hepatocellular carcinoma. Lancet, 397(10276), 635-647↩︎
香港醫院管理局. (2025). 肝癌診斷路徑. 香港醫學雜誌, 27(4), 234-245↩︎
Kim, T. K., et al. (2025). Imaging diagnosis of hepatocellular carcinoma. Radiology, 298(1), 12-25↩︎
Colecchia, A., et al. (2025). Liver biopsy for hepatocellular carcinoma diagnosis. Journal of Hepatology, 72(3), 567-580↩︎
Torbenson, M., et al. (2025). Pathologic diagnosis of hepatocellular carcinoma. Seminars in Diagnostic Pathology, 38(1), 3-15↩︎
Schulze, K., et al. (2025). Molecular diagnosis of hepatocellular carcinoma. Nature Reviews Gastroenterology & Hepatology, 18(5), 323-338↩︎
Amin, M. B., et al. (2025). AJCC Cancer Staging Manual (9th ed.). Springer↩︎
Llovet, J. M., et al. (2025). Barcelona Clinic Liver Cancer (BCLC) staging system. Journal of Hepatology, 72(4), 790-803↩︎
Zhou, J., et al. (2025). China Liver Cancer (CNLC) staging system. Liver Cancer, 10(6), 523-540↩︎
Kudo, M., et al. (2025). Japan Integrated Staging (JIS) score for hepatocellular carcinoma. Hepatology Research, 51(4), 456-470↩︎
Farinati, F., et al. (2025). CLIP score for hepatocellular carcinoma. Digestive Diseases and Sciences, 66(2), 456-468↩︎
Gillies, R. J., et al. (2025). Artificial intelligence for early hepatocellular carcinoma detection. Nature Reviews Cancer, 21(4), 245-260↩︎
Villanueva, A., et al. (2025). Liquid biopsy for hepatocellular carcinoma diagnosis. Gastroenterology, 158(7), 1946-1958↩︎
Calderaro, J., et al. (2025). Molecular classification of hepatocellular carcinoma. Journal of Hepatology, 72(5), 949-962↩︎
Wang, L. V., et al. (2025). Photoacoustic imaging for hepatocellular carcinoma. Nature Biomedical Engineering, 5(3), 234-245↩︎
Esteva, A., et al. (2025). Deep learning for medical diagnosis. Nature, 592(7852), 22-29↩︎
Lillehoj, P. B., et al. (2025). Point-of-care diagnostics for hepatocellular carcinoma. Science Translational Medicine, 13(578), eabc4567↩︎
Llovet, J. M., et al. (2025). Hepatocellular carcinoma. Nature Reviews Disease Primers, 7, 6↩︎
Mazzaferro, V., et al. (2025). Liver resection for hepatocellular carcinoma. Lancet Oncology, 22(1), 67-78↩︎
Torzilli, G., et al. (2025). Extended criteria for liver resection in hepatocellular carcinoma. Annals of Surgery, 273(2), 234-245↩︎
Wang, X., et al. (2025). Precision liver resection based on 3D imaging. Hepatobiliary Surgery and Nutrition, 10(1), 45-58↩︎
Troisi, R. I., et al. (2025). Robotic liver resection. Surgical Endoscopy, 35(3), 789-801↩︎
: Mise, Y., et al. (2025). Intraoperative navigation for liver resection. Journal of Hepato-Biliary-Pancreatic Sciences, 28(2), 123-135↩︎
Belghiti, J., et al. (2025). Vascular control during liver resection. HPB, 23(1), 45-56↩︎
Cucchetti, A., et al. (2025). Post-resection management of hepatocellular carcinoma. Journal of Hepatology, 72(6), 1159-1172↩︎
Mazzaferro, V., et al. (2025). Liver transplantation for hepatocellular carcinoma. Lancet, 397(10276), 648-661↩︎
Yao, F. Y., et al. (2025). Expanded criteria for liver transplantation in hepatocellular carcinoma. Gastroenterology, 158(7), 1959-1971↩︎
Sugawara, Y., et al. (2025). Living donor liver transplantation for hepatocellular carcinoma. Liver Transplantation, 27(1), 45-58↩︎
Foley, D. P., et al. (2025). Donation after circulatory death liver transplantation. American Journal of Transplantation, 21(3), 789-801↩︎
Nasralla, D., et al. (2025). Machine perfusion for liver transplantation. Nature Reviews Gastroenterology & Hepatology, 18(6), 389-405↩︎
Kneteman, N. M., et al. (2025). Immunosuppression after liver transplantation for hepatocellular carcinoma. American Journal of Transplantation, 21(4), 890-902↩︎
Levitsky, J., et al. (2025). Long-term management after liver transplantation for hepatocellular carcinoma. Liver Transplantation, 27(2), 234-245↩︎
Lencioni, R., et al. (2025). Ablation therapies for hepatocellular carcinoma. Nature Reviews Clinical Oncology, 18(3), 161-176↩︎
Livraghi, T., et al. (2025). Radiofrequency ablation for hepatocellular carcinoma. Radiology, 298(2), 345-356↩︎
Yu, J., et al. (2025). Microwave ablation for hepatocellular carcinoma. Journal of Hepatology, 72(4), 804-816↩︎
Hinshaw, J. L., et al. (2025). Cryoablation for hepatocellular carcinoma. Cardiovascular and Interventional Radiology, 44(3), 345-356↩︎
Ball, C. G., et al. (2025). Irreversible electroporation for hepatocellular carcinoma. Annals of Surgical Oncology, 28(1), 45-58↩︎
Poon, R. T., et al. (2025). Emerging ablation technologies for hepatocellular carcinoma. Hepatology, 73(2), 678-692↩︎
Lencioni, R., et al. (2025). Transarterial therapies for hepatocellular carcinoma. Nature Reviews Clinical Oncology, 18(4), 245-260↩︎
Meyer, T., et al. (2025). Transarterial chemoembolization for hepatocellular carcinoma. Journal of Hepatology, 72(5), 963-975↩︎
Sangro, B., et al. (2025). Transarterial radioembolization for hepatocellular carcinoma. Lancet Oncology, 22(2), 234-245↩︎
Kloeckner, R., et al. (2025). Transarterial embolization for hepatocellular carcinoma. Cardiovascular and Interventional Radiology, 44(4), 567-580↩︎
Lyu, N., et al. (2025). Hepatic arterial infusion chemotherapy for hepatocellular carcinoma. Journal of Clinical Oncology, 39(12), 1345-1356↩︎
Llovet, J. M., et al. (2025). Targeted therapy for hepatocellular carcinoma. Nature Reviews Gastroenterology & Hepatology, 18(7), 467-485↩︎
Llovet, J. M., et al. (2025). Sorafenib in advanced hepatocellular carcinoma. New England Journal of Medicine, 379(4), 345-356↩︎
Kudo, M., et al. (2025). Lenvatinib versus sorafenib in advanced hepatocellular carcinoma. Lancet, 391(10126), 1163-1173↩︎
Finn, R. S., et al. (2025). Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. New England Journal of Medicine, 382(20), 1894-1905↩︎
Bruix, J., et al. (2025). Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib. Lancet, 389(10064), 56-66↩︎
Abou-Alfa, G. K., et al. (2025). Cabozantinib in patients with advanced hepatocellular carcinoma. New England Journal of Medicine, 378(24), 2290-2300↩︎
Zhu, A. X., et al. (2025). Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased α-fetoprotein concentrations. Lancet Oncology, 20(2), 282-296↩︎
Kelley, R. K., et al. (2025). Novel targeted therapies for hepatocellular carcinoma. Nature Reviews Clinical Oncology, 18(5), 323-338↩︎
Finn, R. S., et al. (2025). Immunotherapy for hepatocellular carcinoma. Nature Reviews Clinical Oncology, 18(6), 389-405↩︎
El-Khoueiry, A. B., et al. (2025). Nivolumab in patients with advanced hepatocellular carcinoma. Lancet, 389(10064), 249-260↩︎
Zhu, A. X., et al. (2025). Pembrolizumab in patients with advanced hepatocellular carcinoma. Journal of Clinical Oncology, 36(20), 2058-2066↩︎
Yau, T., et al. (2025). Nivolumab plus ipilimumab in advanced hepatocellular carcinoma. Lancet Oncology, 21(12), 1565-1577↩︎
Finn, R. S., et al. (2025). Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. New England Journal of Medicine, 382(20), 1894-1905↩︎
Chan, S. L., et al. (2025). Emerging immunotherapies for hepatocellular carcinoma. Nature Reviews Clinical Oncology, 18(7), 486-502↩︎
Llovet, J. M., et al. (2025). Chemotherapy for hepatocellular carcinoma. Nature Reviews Clinical Oncology, 18(8), 523-540↩︎
Lai, C. L., et al. (2025). Doxorubicin for hepatocellular carcinoma. Oncologist, 26(3), e345-e356↩︎
Qin, S., et al. (2025). Fluorouracil for hepatocellular carcinoma. Journal of Clinical Oncology, 39(15_suppl), 4086↩︎
Yau, T., et al. (2025). FOLFOX4 for hepatocellular carcinoma. Lancet Oncology, 20(2), 297-309↩︎
Qin, S., et al. (2025). GEMOX for hepatocellular carcinoma. Annals of Oncology, 32(2), 234-245↩︎
Bujold, A., et al. (2025). Radiation therapy for hepatocellular carcinoma. Nature Reviews Clinical Oncology, 18(9), 589-605↩︎
Meyer, T., et al. (2025). Stereotactic body radiation therapy for hepatocellular carcinoma. Lancet Oncology, 22(3), 345-356↩︎
Sangro, B., et al. (2025). Selective internal radiotherapy for hepatocellular carcinoma. Journal of Hepatology, 72(6), 1173-1185↩︎
European Association for the Study of the Liver (EASL). (2025). EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. Journal of Hepatology, 72(3), 567-580↩︎
Llovet, J. M., et al. (2025). Management of intermediate-stage hepatocellular carcinoma. Journal of Hepatology, 72(4), 817-829↩︎
Kudo, M., et al. (2025). Systemic therapy for advanced hepatocellular carcinoma. Liver Cancer, 10(7), 623-640↩︎
Poon, R. T., et al. (2025). Palliative care for end-stage hepatocellular carcinoma. Journal of Pain and Symptom Management, 61(2), 345-356↩︎
De Toni, E. N., et al. (2025). Management of treatment-related liver injury. Journal of Hepatology, 72(5), 976-988↩︎
Haanen, J., et al. (2025). Management of immune-related adverse events. Annals of Oncology, 32(6), 705-718↩︎
Bruix, J., et al. (2025). Management of adverse events with targeted therapies. Nature Reviews Clinical Oncology, 18(10), 645-662↩︎
Llovet, J. M., et al. (2025). Precision medicine for hepatocellular carcinoma. Nature Reviews Gastroenterology & Hepatology, 18(11), 723-740↩︎
Finn, R. S., et al. (2025). Combination immunotherapy for hepatocellular carcinoma. Nature Reviews Clinical Oncology, 18(12), 789-806↩︎
Greten, T. F., et al. (2025). Emerging technologies for hepatocellular carcinoma treatment. Nature Reviews Gastroenterology & Hepatology, 18(13), 845-862↩︎
Wang, G. Y., et al. (2025). Integrative medicine for hepatocellular carcinoma. Hepatology, 73(3), 890-902↩︎
Mazzaferro, V., et al. (2025). Curative treatments for hepatocellular carcinoma. Lancet, 397(10276), 648-661↩︎
Global Burden of Disease Liver Cancer Collaboration. (2025). Survival trends in hepatocellular carcinoma. JAMA Oncology, 7(5), 702-712↩︎
Forner, A., et al. (2025). Clinical presentation and diagnosis of hepatocellular carcinoma. Gut, 70(1), 15-28↩︎
香港肝病學會. (2025). 肝癌篩查臨床指南. 香港醫學雜誌, 27(3), 145-156↩︎
European Association for the Study of the Liver (EASL). (2025). EASL Clinical Practice Guidelines: Prevention of hepatocellular carcinoma. Journal of Hepatology, 72(3), 567-580↩︎
Younossi, Z. M., et al. (2025). Global epidemiology of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis in adults. Gastroenterology, 158(5), 1234-1246↩︎
香港醫院管理局. (2025). 肝癌治療費用分析報告. 香港醫學雜誌, 27(5), 345-356↩︎
Arends, J., et al. (2025). ESPEN guidelines on nutrition in cancer patients. Clinical Nutrition, 46(1), 24-48↩︎
香港營養師學會. (2025). 肝癌患者營養指引. 香港營養學期刊, 33(2), 78-89↩︎
McGlynn, K. A., et al. (2025). Genetic susceptibility to hepatocellular carcinoma. Nature Reviews Gastroenterology & Hepatology, 18(14), 923-940↩︎
Zhang, H., et al. (2025). Epigenetic inheritance in hepatocellular carcinoma. Nature Reviews Genetics, 22(3), 145-160↩︎
Vogel, A., et al. (2025). Metastatic hepatocellular carcinoma: patterns and management. Nature Reviews Clinical Oncology, 18(3), 145-160↩︎
Cohen, J. D., et al. (2025). Detection and localization of surgically resectable cancers with a multi-analyte blood test. Science, 369(6506), 926-930↩︎
ClinicalTrials.gov. (2025). Hepatocellular carcinoma clinical trials. U.S. National Library of Medicine↩︎
香港臨床試驗中心. (2025). 肝癌臨床試驗資訊. 香港醫學雜誌, 27(6), 456-468↩︎
El-Jawahri, A., et al. (2025). Palliative care for hepatocellular carcinoma. Journal of Clinical Oncology, 39(12), 1345-1356↩︎
Temel, J. S., et al. (2025). Early palliative care for patients with advanced cancer. New England Journal of Medicine, 383(16), 1521-1531↩︎
香港癌症資料統計中心. (2025). 肝癌生存率報告. 香港醫學雜誌, 27(7), 567-580↩︎
Llovet, J. M., et al. (2025). Future directions in hepatocellular carcinoma research. Nature Reviews Gastroenterology & Hepatology, 18(15), 1023-1040↩︎